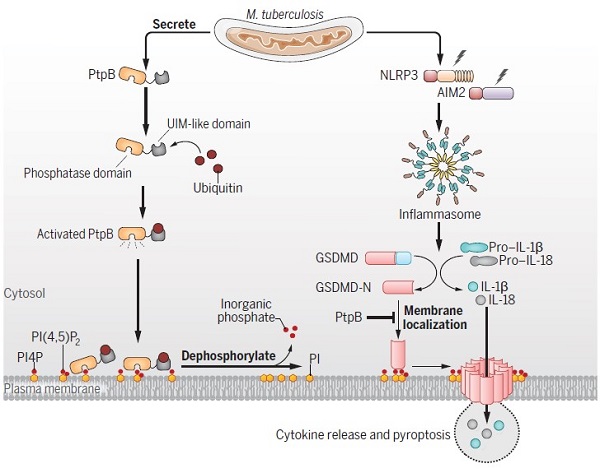
结核病(tuberculosis,TB)是由结核分枝杆菌(M. tuberculosis)感染引起的一类重大慢性传染病。当受到感染刺激时,人体细胞炎症小体(inflammasome)能够迅速组装并使pro-caspase-1发生自剪切产生具有酶活性的caspase-1,后者进一步剪切下游的关键效应分子gasdermin D(GSDMD)及炎性细胞因子前体pro-IL-1β和pro-IL-18,导致质膜产生孔洞,进而介导成熟的炎性细胞因子(IL-1β和IL-18)的释放及细胞焦亡(pyroptosis),从而抵抗病原体感染。

邱小波教授与中国科学院微生物研究所刘翠华研究员团队合作揭示了结核病原菌脂磷酸酶通过劫持宿主泛素而重塑宿主细胞的膜脂组成进而抑制细胞焦亡的病原免疫逃逸新机制(图)。该研究发现,从结核菌中分泌的蛋白磷酸酶PtpB其实是一种脂磷酸酶,在结核病原菌感染时可使质膜上的磷脂酰肌醇磷酸PI4P及PI(4,5)P2去磷酸化,从而抑制GSDMD-N在质膜上的聚集并阻止细胞焦亡及细胞因子IL-1β和IL-18的释放。进一步研究发现PtpB依赖一个特殊的泛素结合模序(UIM-like)结合宿主泛素并激活其脂磷酸酶活性,导致质膜中PI4P和PI(4,5)P2丰度减少进而抑制GSDMD-N在质膜上的聚集和细胞焦亡。这些结果为基于病原-宿主互作界面的结核治疗提供了新思路。
相关研究结果已于10月14日发表于Science,题为“A bacterial phospholipid phosphatase inhibits host pyroptosis by hijacking ubiquitin”。中国科学院微生物研究所柴琪瑶博士为第一作者,刘翠华研究员、汪静研究员和邱小波教授为共同通讯作者。该研究得到了国家重点研发计划等项目的支持。
文章链接:A bacterial phospholipid phosphatase inhibits host pyroptosis by hijacking ubiquitin | Science